Loeng 8. Gaasid: olekuvõrrand ja faasidiagramm
Termodünaamika.
Gaaside olekut kirjeldavat füüsika osa nimetatakse tavaliselt termodünaamikaks.
Kui püüda seda terminit kreeka keele abiga seletada, saame liitsõna
therme+dynamo, mis peaks tähendama soojus-jõudu. Ajalooliselt on siin
tõetera sees, kuna oma arengu eest võlgneb see füüsika haru tänu
soojusjõumasinate rakendamisele 18. saj lõpul.
Soojuse mõiste on väga
vana, mõõtma õpiti teda aga suhteliselt hiljuti. Põhjuseks on asjaolu,
et veel Newtoni aegadel loeti soojust aineks ning üritati teda eraldada
ja kaaluda; ka gaaside paisumist soojendamisel (18. sajandini ainus
temperatuuri mõõtmise viis) seletati soojusaine juurdevooluga.
Soojuse (ja temperatuuri) mõiste põhineb soojusaistingul. Kui me
oleks kõigusoojased, vaevalt siis niipea sellele tähelepanu oleks
pööratud. Püsisoojaste loomade-lindude jaoks on aga kehatemperatuuri
säilitamine üks tähtsamaid eluülesandeid ning sellest tulenev väga täpne
temperatuuritaju pidi varem või hiljem viima vastavate mõõteriistade
rakendamisele.
Termomeetri, mis põhineb vedelike soojuspaisumisel (ja
mis lubab temperatuuri mõõta kuitahes suure täpsusega) arendasid välja
Fahrenheit, Reamur ja Celsius aastatel 1714 -- 1750; nende erinevail
gradueeringutel põhinevad skaalad on kasutusel tänapäevani.
Tänapäeva füüsika seisukohalt pole termodünaamika sisuks mitte
niivõrd soojuse kui gaaside käitumine. Et gaasi kokkusurumisel
(ruumala vähendamisel) rõhk kasvab, oli ammu teada; aga selle
matemaatiline kirjeldamine nõudis kahe tähtsa asja äratabamist.
Esiteks seda, et lisaks ruumala muutustele sõltub rõhu muutus ka
temperatuurist ning teiseks asjaolu, et rõhk meie ümber erineb
oluliselt nullist. Just õhurõhu mõõtmine ning termomeetrite
avastamine 17. saj lõpul tegid võimalikuks gaasi oleku
matemaatilise kirjeldamise.
|
Gaaside oleku kirjeldamisel on vajalik täiendav olekuparameeter temperatuur.
Temperatuuri mõiste on seotud soojusaistinguga.
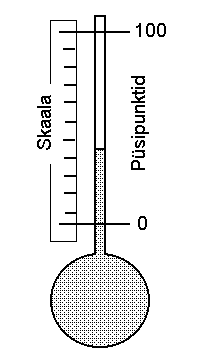
Vedeliktermomeeter:
vedelikuga täidetud mahukas anum on ühendatud peene toruga, kus soojuspaisumisega kaasnev nivoo muutus on kergesti mõõdetav.
Temperatuuriskaala põhineb kahel püsipunktil. Celsiuse skaalal on nendeks vee tahkumistemperatuur (0°C) ja vee keemistemperatuur (100°C). Viimane sõltub rõhust.
|
Et 18. sajand oli mehaanika õitseaeg, arenes koos eksperimentaalse
termodünaamikaga ka selle mehhanistlik teooria -- molekulaarfüüsika.
See, et kõik termodünaamika seadused on seletatavad-tuletatavad
suure hulga molekulide juhuslike liikumiste statistiliste näitajate
abil, on vaadeldavale füüsika lõigule andnud veel kolmandagi nimetuse
-- statistiline füüsika. Statistiline füüsika omakorda on mõjutanud
paljude teiste füüsikaharude, eelkõige optika ja aatomifüüsika arengut.
|
Gaaside teooriast on välja arenenud molekulaarfüüsika.
Kõiki termodünaamika seadusi on võimalik tuletada eeldusest, et gaas on vabalt liikuvate aineosakeste -- molekulide -- kogum.
|
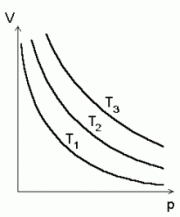
Boyle-Mariotte'i seadus:
gaasi isotermid (sama temperatuuri jooned) p -- V teljestikus.
|
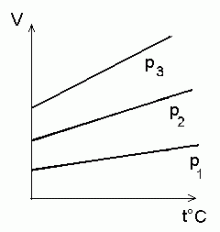
Gay-Lussac'i seadus:
gaasi isobaarid (sama rõhu jooned) V -- t° teljestikus.
|
|
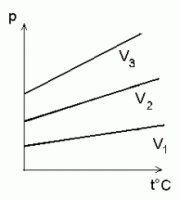 Charles'i seadus:
Charles'i seadus:
ideaalse gaasi isohoorid (sama ruumala jooned) p -- t° teljestikus.
|
Gaasi olekuvõrrand.
1676. a. avaldas B. Mariotte esimese gaaside kohta käiva
seaduse, mis kirjeldas kvantitatiivselt rõhu sõltuvust gaasi
ruumalast konstantsel temperatuuril. Kuna hiljem selgus, et sama
seaduse oli kirja pannud keemik R. Boyle juba 12 aastat varem,
tuntakse teda tänapäeval Boyle-Mariotte'i seaduse nime
all.
Konstantsel temperatuuril on gaasi rõhu ja ruumala
korrutis jääv suurus.
|
Gaasi olekuvõrrand seob kolme olekuparameetrit
rõhku
ruumala
temperatuuri
|
|
See on lihtne ja intuitiivselt tajutav seadus, mille
formuleerimiseks tuli siiski teada õhurõhu olemasolu. Seevastu
gaasi parameetrite temperatuurisõltuvus kui tunduvalt keerukam
lasi end veel poolteist sajandit oodata.
1805. a. leidis
L. Gay-Lussac seose ruumala ja temperatuuri vahel
(ruumpaisumise valemi), ning mõni aeg hiljem Charles (loe ša:rl, kuna tegu on prantslasega!) analoogilise
seose rõhu ja temperatuuri vahel. Neid valemeid esitatakse
tavaliselt koos:
Konstandid 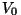 ja ja 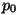 tähistavad vastavalt ruumala ja rõhku
temperatuuril 0 kraadi;
konstant tähistavad vastavalt ruumala ja rõhku
temperatuuril 0 kraadi;
konstant 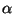 - ruumpaisumistegur - sõltub
temperatuuriskaalast ja on Celsiuse kraadide korral ligikaudu 1/273. - ruumpaisumistegur - sõltub
temperatuuriskaalast ja on Celsiuse kraadide korral ligikaudu 1/273.
19. sajandil oli käibel korraga kolm
temperatuuriskaalat (Celsiuse, Reamuri ja Fahrenheiti omad) ning
igaühele vastas erinev ruumpaisumistegur.
1890. a. näitas W. Thomson, et need seadused avalduvad märksa
lihtsamal kujul, kui nihutada temperatuuriskaala nullpunkt kohta,
kus
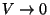 .
Et .
Et 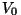 on kindlasti nullist erinev, peab
nulliga võrduma korrutise teine tegur. Nii saame on kindlasti nullist erinev, peab
nulliga võrduma korrutise teine tegur. Nii saame
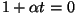 ,
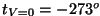 C.
Võttes selle uue skaala nullpunktiks,
saame absoluutseks temperatuuriks 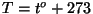 . .
Uut skaalat
nimetame Kelvini skaalaks rakendaja W. Thomsoni aadlinime -
lord Kelvin - järgi. Kelvini skaala ühik on kelvin, tähis K
(ilma kraadimärgita).
Absoluutse (Kelvini) temperatuuri korral on
rõhk ja ruumala võrdelises sõltuvuses temperatuurist:
|
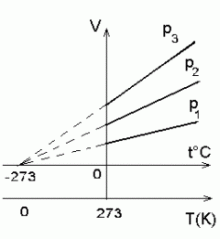
Kelvini skaala:
Isobaaride lõikepunkt t°-teljega (V = 0) vastab temperatuurile -273°C, mis vastab absoluutsele temperatuurile 0K.
|
p = c1 T, kui V = const
V = c2 T, kui p = const
Neid kahte koos kolmanda, Boyle-Mariotte'i seadusega nim.
isoprotsesside võrranditeks; isoprotsess on selline
protsess, kus üks olekuparameetritest on konstantne.
Konstantsel
temperatuuril toimuvat nimetame isotermiliseks,
konstantses
ruumalas toimuvat isohooriliseks ja
konstantsel rõhul
toimuvat isobaariliseks protsessiks.
Võrrandis olevate konstantide 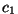 ja ja 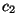 väärtused sõltuvad kahest parameetrist:
üks neist iseloomustab ainet (gaasi), teine aga sõltub sellest,
millises ruumalas (millisel rõhul) protsess toimub.
Viimast saab viia valemisse sisse, ühendades kõik kolm
isoprotsesside võrrandit üheks: väärtused sõltuvad kahest parameetrist:
üks neist iseloomustab ainet (gaasi), teine aga sõltub sellest,
millises ruumalas (millisel rõhul) protsess toimub.
Viimast saab viia valemisse sisse, ühendades kõik kolm
isoprotsesside võrrandit üheks:
kus konstandi väärtus sõltub ainuüksi uuritava gaasi hulgast ja
omadustest.
Püüdes määrata erinevate gaaside konstante, avastas
Clapeyron 1834. a., et kui võtta gaasi hulk võrdseks ühe mooliga,
on kõigi gaaside jaoks konstandil sama väärtus. Seda konstanti
hakati nimetama gaasi universaalkonstandiks.
Seega sai
olekuvõrrand kuju
kus
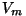 on nn. moolruumala -- ühe mooli gaasi ruumala
temperatuuril on nn. moolruumala -- ühe mooli gaasi ruumala
temperatuuril 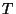 ning rõhul ning rõhul 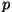 , ,
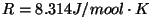 on gaasi
universaalkonstant. on gaasi
universaalkonstant.
|
Kui gaasi kogust mõõta moolides, on olekuvõrrand kõigi gaaside jaoks ühesugune.
|
|
Mool, vana nimetusega gramm-molekul, on selline
gaasi hulk, mille mass grammides on arvuliselt võrdne aine
molaarmassiga;
molaarmass omakorda pärineb keemiliste
reaktsioonide teooriast ja väljendab reaktsioonides osalevate
ainet suhtelisi hulki.
Vesinikuaatomi mass loetakse tinglikult
üheks (molaarmass kaheaatomilise vesiniku jaoks on 2) jne., vt.
Mendelejevi tabel.
Moolides väljendatud aine kogust
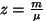 ,
kus 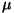 on molaarmass, nimetatakse
ainehulgaks.
Lõppkokkuvõttes saab gaasi olekuvõrrand kuju on molaarmass, nimetatakse
ainehulgaks.
Lõppkokkuvõttes saab gaasi olekuvõrrand kuju
mis on tuntud Clapeyroni-Mendelejevi võrrandi nime all.
Olekuvõrrand annab seose kolme suuruse - gaasi
olekuparameetrite 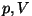 ja ja 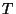 vahel tasakaaluolekus. vahel tasakaaluolekus.
Üldse räägitakse termodünaamikas mitte gaasist endast, vaid
selle olekust, mõeldes viimase all olekuparameetrite väärtuste
komplekti.
Olekuparameetrite muutumist nimetame termodünaamikas
protsessiks;
kui see on väljendatav tasakaaluolekute
ajalise järgnevusena, on protsess tasakaaluline.
Kui meid
huvitab üksnes alg- ja lõppolek, võime tasakaaluliste
protsesside valemeid rakendada ka kiiresti kulgevate
(mittetasakaaluliste) protsesside korral.
Loomulikult on mingi kindla gaasi olekuvõrrand kehtiv vaid
selles temperatuurivahemikus, kus vaadeldav aine on gaasilises
faasis. Sellest madalamal temperatuuril tuleb arvestada
faasiülemineku võimalust (kogu gaas või osa sellest läheb üle
vedelasse või tahkesse olekusse); kõrgematel temperatuuridel
katkeb keemiline side (muutub gaasi koostis) või eemaldatakse
aatomist elektron (gaas ioniseeritakse).
Gaasi, mille olekut kirjeldab Clapeyroni-Mendelejevi võrrand,
nimetatakse ideaalseks gaasiks. Reaalsed gaasid käituvad
ideaalsetena ainult kindlas temperatuurivahemikus.
Reaalsed ained. Igapäevaelust teame, et
enamus aineid on tahkes olekus. Kui neid kuumutada, nad
sulavad, minnes vedelasse olekusse. Väga kõrgel
temperatuuril ained aurustuvad - tekib gaasiline olek.
Seega sõltub aine olek temperatuurist; normaaltingimustes
gaasilistel ainetel on lihtsalt meile harjumuspärastest
temperatuuridest madalam keemistemperatuur. Kui näiteks
lämmastikku jahutada -196 Celsiuse kraadini (77K), muutub ta
vedelaks, temperatuuril -210° (63K) tahkeks. Et mõlemad
temperatuurid on looduses esinevaist palju madalamad, tunnemegi
lämmastikku gaasina.
Öeldust järeldub, et ülimadalatel temperatuuridel ei käitu gaasid
sugugi Clapeyroni-Mendelejevi olekuvõrrandi kohaselt.
Tegelikult ilmnevad kõrvalekalded ka tavalistel temperatuuridel.
Nii on näiteks lämmastiku ruumala 500 atmosfäärisel rõhul 40%, 1000 atmosfääri juures aga kaks korda suurem olekuvõrrandiga määratust.
Möödunud sajandi keskel tuletati
rida empiirilisi (katseandmetel põhinevaid) valemeid gaaside
käitumise kohta suurtel
rõhkudel ja madalatel temperatuuridel, ajaproovile on neist
vastu pidanud hollandi füüsiku J. D. van der Waals'i poolt
1873. a. tuletatu:
kus 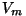 on ühe mooli gaasi poolt täidetav ruumala
(moolruumala), on ühe mooli gaasi poolt täidetav ruumala
(moolruumala), 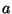 ja ja 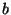 aga empiirilised konstandid. aga empiirilised konstandid.
|
Gaaside käitumist suurtel rõhkudel (tihedustel) ja madalal temperatuuril kirjeldab Van der Waals'i võrrand.
|
Oma
valemi tuletamisel lähtus van der Waals kahest eeldusest:
- molekulidel on lõplikud mõõtmed (nad pole
punktmassid);
- molekulide vahel mõjuvad kaugusest sõltuvad tõmbejõud.
Ruumalast lahutatav konstant 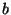 määrabki nn omaruumala -
ruumala, mille täidaksid määrabki nn omaruumala -
ruumala, mille täidaksid 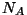 (Avogadro arv) molekuli tihedalt
kokku pakituna. Konstant (Avogadro arv) molekuli tihedalt
kokku pakituna. Konstant 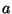 on keerulisema ideoloogiaga: et aga on keerulisema ideoloogiaga: et aga
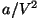 on rõhu dimensiooniga nimetatakse seda tihti siserõhuks.
Siserõhu põhjustajaks peetakse molekulide vahelisi jõudusid, neist
edaspidi. on rõhu dimensiooniga nimetatakse seda tihti siserõhuks.
Siserõhu põhjustajaks peetakse molekulide vahelisi jõudusid, neist
edaspidi.
Miks on lisarõhk positiivse, omaruumala aga negatiivse märgiga?
Arutleda võib kaht moodi: energeetilisest seisukohast on
korrutis 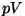 võrdne tööga, mida tuleks teha gaasi
kokkusurumiseks antud ruumalani võrdne tööga, mida tuleks teha gaasi
kokkusurumiseks antud ruumalani 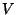 . Et osa tööst teevad ära
molekulaarjõud, tuleb see liige positiivne (tema võrra võib
tegelik (välis)rõhk olla väiksem). Omaruumala seevastu on
algusest peale "mängust väljas" - siit negatiivne märk. . Et osa tööst teevad ära
molekulaarjõud, tuleb see liige positiivne (tema võrra võib
tegelik (välis)rõhk olla väiksem). Omaruumala seevastu on
algusest peale "mängust väljas" - siit negatiivne märk.
Kui lugeda molekulid punktmassideks, saab võrrandi mõlemat liiget kirjeldada
molekulide vaheliste jõududega. "Omaruumala" asendab siis
tõukejõud, mis molekulide vahelise kauguse kasvades
kahaneb kiiremini kui samade molekulide vaheline tõmbejõud.
(See teooria kuulub küll rohkem tahke oleku juurde.)
Van der Waalsi isotermid. Nagu olekuvõrrandis ikka, on
ka Van der Waals'i võrrandi korral kõige huvipakkuvam 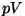 teljestik, st. seos rõhu ja ruumala vahel. Erinevatele
temperatuuridele vastavate isotermide kuju sõltub nüüd ennekõike
lisarõhu liikmest, kus nimetajas paiknev ruumala ruut
muudab seose
teljestik, st. seos rõhu ja ruumala vahel. Erinevatele
temperatuuridele vastavate isotermide kuju sõltub nüüd ennekõike
lisarõhu liikmest, kus nimetajas paiknev ruumala ruut
muudab seose 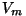 suhtes kuupvõrrandiks: suhtes kuupvõrrandiks:
See seos ei garanteeri rõhu ja ruumala vahel üks-ühest
sõltuvust: kuupvõrrandi lahendite arv võib olla üks, kaks või
kolm, sõltuvalt kordajatest (tegelikult on lahendeid alati kolm,
kuid meid huvitavad vaid reaalarvulised ruumalad). Võrrandi
uurimine näitab, et kriitiliseks parameetriks on temperatuur:
kõrgetel temperatuuridel on võrrandil üks reaalarvuline lahend (ja kaks
kompleksarvulist lahendit). Igale konstantide 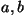 paarile vastab
nn. kriitiline temperatuur, kus võrrand taandub kujule paarile vastab
nn. kriitiline temperatuur, kus võrrand taandub kujule
|
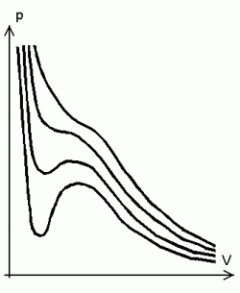
Van der Waals'i isotermid.
|
|
ja millest madalamatel temperatuuridel on lahendeid kolm - gaas on
antud rõhu juures tasakaalulises olekus kolme erineva ruumala (kolme
tiheduse!) korral.
Matemaatiliselt korrektne tulemus on füüsikaliselt mõttetu, kuna
ennustab teatud ruumalade vahemikus rõhu vähenemist gaasi
kokkusurumisel. Katse näitab, et tegelikult eksisteerib
temperatuurist sõltuv rõhk 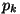 , milleni jõudmisel rõhu kasv
gaasi kokkusurumisel peatub. Seda rõhku nimetatakse
küllastunud auru osarõhuks.
Graafikul paikneb küllastunud auru rõhku kujutav sirge nii, et
samale temperatuurile vastavast van der Waalsi isotermist "välja
lõigatud" pindalad , milleni jõudmisel rõhu kasv
gaasi kokkusurumisel peatub. Seda rõhku nimetatakse
küllastunud auru osarõhuks.
Graafikul paikneb küllastunud auru rõhku kujutav sirge nii, et
samale temperatuurile vastavast van der Waalsi isotermist "välja
lõigatud" pindalad 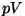 diagrammil on võrdsed. Seega on gaasi
kokkusurumisel tehtav töö nii teoreetilise kui eksperimentaalse
protsessi jaoks ühesugune - energia jäävuse seadus peab ju
kehtima. diagrammil on võrdsed. Seega on gaasi
kokkusurumisel tehtav töö nii teoreetilise kui eksperimentaalse
protsessi jaoks ühesugune - energia jäävuse seadus peab ju
kehtima.
Gaas ja aur. Mis siis ikkagi juhtub gaasiga tema
kokkusurumisel? Kui katse toimub läbipaistvate seintega anumas,
võime näha rõhu jõudmisel väärtuseni 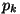 vedeliku teket.
Edasisel kokkusurumisel ei muutu rõhk, küll aga vedeliku
suhteline hulk anumas. Kui ruumala on vähenenud väärtuseni vedeliku teket.
Edasisel kokkusurumisel ei muutu rõhk, küll aga vedeliku
suhteline hulk anumas. Kui ruumala on vähenenud väärtuseni 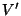 ,
on kogu ruumala täidetud vedelikuga ning selle rõhk
kokkusurumisel kasvab juba hüdrostaatika seaduste järgi. ,
on kogu ruumala täidetud vedelikuga ning selle rõhk
kokkusurumisel kasvab juba hüdrostaatika seaduste järgi.
|
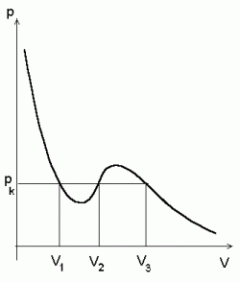
Van der Waals'i gaasi (teoreetiline) isoterm p - V teljestikus kriitilisest madalama temperatuuri korral.
Ruumalade vahemikus V2 -- V1 peaks ruumala vähenemisega kaasnema rõhu kahanemine.
|
|
Vedelikku eristab gaasist just tema ruumala (tiheduse) sõltumatus
rõhust. Van der Waalsi teooria järgi tähendab see siserõhu
prevaleerimist (ld.
prevalere - ülekaalus olema)
molekulaar-kineetilise rõhu üle.
Kui piltlikult seletada, hoiavad
vedeliku molekulid üksteist kinni, laskmata neil vabalt liikuda. Kui
vedeliku sees oleva molekuli jaoks on ümbritsevate molekulide
tõmbejõud tasakaalus, siis pinnal asuvat molekuli tõmmatakse
vedeliku sisse (meile harjumuspärasel juhul, st Maa
gravitatsiooniväljas, kus vedeliku tasakaaluline pind on
horisontaalne, järelikult allapoole). Tekib "pinnakile", millest
läbiminek nõuab kindlat energiat. Et vedeliku molekulide kiirused
on erinevad (täpsemalt järgmises loengus), on alati olemas kindel
hulk molekule, mille kineetilisest energiast piisab vedelikust
väljumiseks. Need molekulid moodustavad vedeliku pinna kohal
gaasilise keskkonna, mida nimetatakse auruks.
Seega võime
kasutada mõistet "aur" üksnes kriitilisest madalamatel
temperatuuridel, kus on võimalik vedela faasi olemasolu.
|
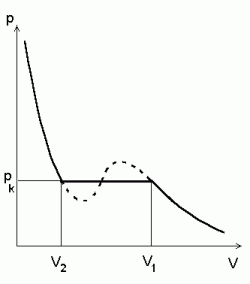
Reaalne isoterm.
Rõhul pk toimub gaasi veeldumine.
Mida kõrgem temperatuur, seda suurem on pk.
|
Kuna auru molekulid liiguvad ruumis vabalt, võib igaüks neist
uuesti sattuda vedelikku. Aurust vedelikku minevate molekulide
hulk sõltub auru tihedusest, see omakorda rõhust. Et vedelikust
väljuvate molekulide arv sõltub üksnes temperatuurist,
eksisteerib paratamatult väline piirrõhk, mille korral tagasi
vedelikku siirduvate molekulide arv saab võrdseks väljuvate
molekulide arvuga. Sellest suuremaks rõhk kasvada ei saa ja
seetõttu nimetataksegi sellist auru küllastunud auruks,
tema rõhku aga küllastunud auru rõhuks. Kui rõhk vedeliku
kohal on madalam, kui 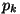 , vedelik aurub; kui suurem, siis aur
kondenseerub. , vedelik aurub; kui suurem, siis aur
kondenseerub.
Igapäevaelus tuntud vedelike (vesi, piiritus, bensiin, elavhõbe)
küllastunud aurude rõhk on palju väiksem normaalsest
atmosfäärirõhust (näiteks veel temperatuuril
20° C 2400 Pa ehk
0.024 atmosfääri). Seetõttu võime küllastunud auru rõhku uurida
vaid suletud anumates, vabas atmosfääris saame rääkida vaid
aurude osarõhust. Nagu eelnevast näeme, on veeauru
maksimaalne osarõhk 20-kraadisel temperatuuril vaid 2.4%
kogurõhust, madalamatel temperatuuridel veelgi väiksem.
Atmosfäärifüüsikas ja meteoroloogias hinnatakse tavaliselt
suhtelist niiskust, mis kujutab endast õhu tegeliku
niiskusesisalduse suhet maksimaalsesse, väljendatuna
protsentides. Nii tähendab relatiivne niiskus temperatuuril
20° C 70% seda, et 1 m3 õhku sisaldab 12.1 g veeauru (70%
17.3-st).
|
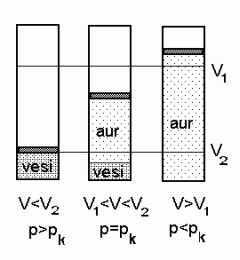
Kriitilise rõhu juures on aine samaaegselt nii vedelas faasis (vesi) kui ka gaasina (aur).
Veeauru tegelikku hulka õhus nimetatakse absoluutseks niiskuseks , selle suhet osarõhule pk vastavasse veeauru hulka suhteliseks niiskuseks .
Tahkes olekus paiknevad aine aatomid (liitaine ioonid) korrapärases kristallvõres.
|
|
Temperatuuri kasvades küllastunud auru osarõhk kasvab, koos
sellega ka absoluutne niiskus. 100° C juures jõuab veeauru
osarõhk ühe atmosfäärini ning kogu vesi aurustub keemise teel.
Kui temperatuuri veel tõsta, jõuame kriitilise temperatuurini
(rõhul 218 atmosfääri ja temperatuuril
374° C), kus kaob
erinevus vedela ja gaasilise faasi vahel. Molekulaarfüüsika
seisukohalt tähendab see, et molekulide tõenäoseim kineetiline
energia ületab molekulaarjõudude poolt määratud väljumistöö -
vedeliku pinda määravate jõudude mõju kaob ja koos sellega ka
pind ise.
Aine kolm olekut molekulaarfüüsika
vaatepunktist. Et vedela oleku tekkes on süüdi
molekulidevahelised tõmbejõud, sai ülaltoodus ära põhjendatud.
Kuidas aga tekib tahke - kristalliline - olek?
Kristalle eristab teistest "ainetükkidest" korrapärane, antud
ühendile iseloomulik kuju. Nii on vasevitrioli ja keedusoola
kristallid risttahuka kujulised, kvarts ja kaltsiit moodustavad
kuuetahulise pulga kujulisi piklikke kristalle, vilgukivi ja
grafiit esinevad õhukeste plaatide kujul. Tänapäeva
uurimismeetodid näitavad, et molekulid (aatomid, ioonid)
paiknevad kristallis mitte tihedalt üksteise vastas, vaid
eraldatult, kuid kindla korrapära kohaselt.
Seda antud ainele
iseloomulikku paigutust nim. kristallvõreks; võre
parameetrid on määratud molekulide (aatomite, ioonide) vaheliste
jõududega.
|
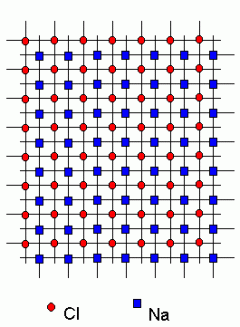
Keedusoola kuubiline kristallvõre.
Nii naatriumi kui kloori ioonid paiknevad kuupide tippudes; vastavad võred on nihutatud nii, et iga kloori ioon paikneb täpselt naatriumi ioonide vahel.
|
Molekulaarjõudude diagramm. Just kristalsete ainete
uurimine on eksperimentaalseks aluseks tänapäeva
molekulaarjõudude teooriale.
See, millest meil juttu tuleb, on
klassikaline teooria, mis rajaneb ainult Newtoni
mehaanikal ega kasuta kvantteooriat.
Kvantteooria on muidugi
täpsem ja kirjeldab paljusid asju paremini, kuid oma keerukuse
ja tahkete ainete suure mitmekesisuse tõttu pole see kaugeltki
nii universaalne. Palju on lahtisi probleeme; tahke oleku
füüsika (uuema terminoloogia järgi "tihenenud aine füüsika"
ingl. physics of condensed matter) moodustab kindlalt üle
poole kaasaegsest füüsikast.
Klassikalise teooria järgi ümbritseb iga molekuli kaks erinevat
jõuvälja. Mõlemat kirjeldatakse astmefunktsiooniga 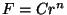 . Üks neist,
tõukejõudude väli, kahaneb kauguse kasvades kiiremini (kõige
paremini sobib astendaja
n = - 13), teine - tõmbejõudude väli
aga aeglasemalt (astendaja n = - 7). Molekuli lähedale sattunud
osake algul tõmmatakse külge (tõmbejõud ulatuvad kaugemale),
seejärel aga pidurdatakse tõukejõudude poolt. Jõudude diagramm
on kujutatud kõrvalasuval joonisel. . Üks neist,
tõukejõudude väli, kahaneb kauguse kasvades kiiremini (kõige
paremini sobib astendaja
n = - 13), teine - tõmbejõudude väli
aga aeglasemalt (astendaja n = - 7). Molekuli lähedale sattunud
osake algul tõmmatakse külge (tõmbejõud ulatuvad kaugemale),
seejärel aga pidurdatakse tõukejõudude poolt. Jõudude diagramm
on kujutatud kõrvalasuval joonisel.
Graafikul on tõmbejõud (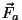 vastassuunaline
raadiusvektoriga vastassuunaline
raadiusvektoriga 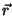 , seega märk negatiivne) antud tiheda
punktiiriga, tõukejõud ( , seega märk negatiivne) antud tiheda
punktiiriga, tõukejõud (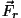 ja ja 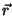 samasuunalised,
märk positiivne) aga hõreda punktiiriga. Summaarne jõud samasuunalised,
märk positiivne) aga hõreda punktiiriga. Summaarne jõud
on antud pideva joonega ning kujutab endast miinimumiga kõverat.
Vaadeldavale molekulile lähenev osake (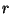 kahaneb) kahaneb)
satub
kõigepealt (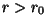 ) tõmbejõudude mõju alla; punktis ) tõmbejõudude mõju alla; punktis 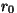 osake
hetkeks vabaneb ( osake
hetkeks vabaneb (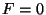 , kuna , kuna 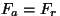 ; indeks ; indeks 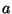 tähendab
tõmmet - ingl. attractor; tähendab
tõmmet - ingl. attractor; 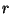 aga tõuget - ingl.
repulsor),
seejärel aga tõugatakse kiiresti eemale. aga tõuget - ingl.
repulsor),
seejärel aga tõugatakse kiiresti eemale.
|
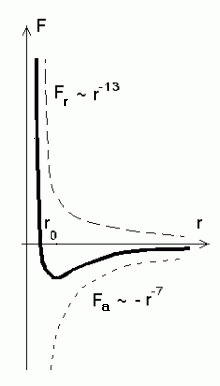
Molekulaarjõudude diagramm.
|
|
Kokkuvõttes jääb tõukejõudude lühiajaline mõju märkamatuks,
mistõttu osakese trajektoor on asümptootiliselt (kaugel
molekulist) sarnane van der Waalsi teooriast tulenevaga.
Oluliseks muutuvad tõukejõud aga tahke ja vedela oleku
kirjeldamisel Selleks joonistame mingi kahest molekulist
moodustatud süsteemi energiakõvera. Et energia muut on võrdne
tööga, mis omakorda on integraal jõust üle tee pikkuse, saame
jõudiagrammile väga sarnase kõvera (integraal astmefunktsioonist
on samuti astmefunktsioon).
Nagu tavaliselt, on potentsiaalne energia normeeritud tingimusega
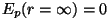 ja negatiivne energia tähendab seotud süsteemi
(osakesed ei saa teineteisest eemalduda tõmbejõudude olemasolu
tõttu). Tasakaaluoleku määrab energia miinimum; kui
soojusliikumist ei oleks, asuksid osakesed teineteisest kaugusel ja negatiivne energia tähendab seotud süsteemi
(osakesed ei saa teineteisest eemalduda tõmbejõudude olemasolu
tõttu). Tasakaaluoleku määrab energia miinimum; kui
soojusliikumist ei oleks, asuksid osakesed teineteisest kaugusel
 , ning tekiks korrapärane kristallvõre. , ning tekiks korrapärane kristallvõre.
Soojusliikumise tõttu lisandub kineetiline energia, mille
tulemusena koguenergia suureneb 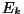 võrra. Mida soojem on aine,
seda suuremaks muutub osakese liikumisvabadus tasakaaluasendi suhtes.
Alates teatud temperatuurist ulatub "lubatud" kaugus tasakaaluasendist
naaberosakesteni ja nii võib vaadeldav molekul ainetüki piires vabalt
"rännata", jäädes viimasega ikkagi seotuks. See on vedel olek. võrra. Mida soojem on aine,
seda suuremaks muutub osakese liikumisvabadus tasakaaluasendi suhtes.
Alates teatud temperatuurist ulatub "lubatud" kaugus tasakaaluasendist
naaberosakesteni ja nii võib vaadeldav molekul ainetüki piires vabalt
"rännata", jäädes viimasega ikkagi seotuks. See on vedel olek.
|
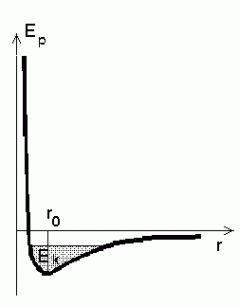
Molekuli energiadiagramm.
Kõver näitab molekuli potentsiaalset energiat teiste molekulide mõjuväljas. Kineetilise energia lisamine (viirutatud piirkond) loob täiendava liikumisvabaduse võresõlme ümber.
|
|
Kui kineetiline energia saab võrdseks-suuremaks molekulaarjõudude
potentsiaalsest energiast, hakkavad molekulid ruumis vabalt liikuma.
Aine läheb gaasilisse olekusse.
Selline oleks kõige lihtsam pilt aine eri olekutest (faasidest) ja
üleminekutest nende vahel (faasisiiretest). Muidugi on reaalne maailm
hulga keerukam ning vastavalt on keerulisem ka seda maailma kirjeldav
füüsika-matemaatika.
|
|
Olekudiagramm.
Olekute jaotumist rõhu ja temperatuuri järgi nim.
olekudiagrammiks. Tavaliselt esitatakse see 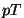 -teljestikus
erinevate faaside piirjoonte abil. Joonisel on kolmikpunkt
tähistatud K-tähega; seal ühinevad -teljestikus
erinevate faaside piirjoonte abil. Joonisel on kolmikpunkt
tähistatud K-tähega; seal ühinevad
- sublimatsioonikõver OK,
- aurustumiskõver KB, (B
on kriitiline punkt) ja
- sulamiskõver KA
Viimasest vasakule jääb tahke faasi
piirkond;
selle ja aurustumiskõvera vahele vedel faas (ulatub
vaid kriitilise temperatuurini
Tkr , graafikul punkt B)
ning
ülejäänud osa võtab
enda alla gaasiline faas.
Vaatame aine oleku muutumist (faasisiirdeid) mingil rõhul 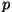 . .
Madalatel temperatuuridel on aine molekulid seotud kristallvõresse -
aine on tahkes olekus. Kui temperatuur tõuseb, hakkab osake võnkuma
tasakaaluasendi ümber ning kristallvõre mõõtmed mõnevõrra
suurenevad - tekib soojuspaisumine.
Temperatuuri lähenemisel sulamistäpile tekib olukord, kus
molekulide võnkumisamplituud ulatub naabersõlmedeni. Algavad
"kohtade vahetused", kristallvõre püsib aga seni, kuni summaarne
kineetiline energia ületab võre ehitamisel vabanenud energia.
Võre lõhkumiseks vajalikku energiat nim. sulamissoojuseks
ja see võib (tugevalt ebasümmeetriliste molekulide korral) olla
väga suur (jääl näiteks 335 kJ/kg, 80 korda suurem
erisoojusest). Et sulamistemperatuur on seotud kristallvõre
energiaga, ei sõltu ta praktiliselt välisrõhust.
Vedelas olekus pole molekulid seotud kindla asukohaga, vaid
võivad piisa piires vabalt liikuda. Selline keha ei oma kindlat
kuju, küll aga on määratud tema ruumala: see võrdub molekulide
koguarvu ja ühele molekulile "ette nähtud" ruumala 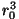 korrutisega (
korrutisega ( on tasakaaluline kaugus). on tasakaaluline kaugus).
Selline oleks pilt juhul, kui kõigi molekulide kineetilised energiad
oleksid võrdsed. Tegelikult on mingi osa molekulide kineetiline
energia alati suurem "seoseenergiast". Need molekulid on
vabad, ja kui nad oma teel kiirust ei kaota (näiteks põrkel
teiste molekulidega), võivad nad piisast lahkuda. Vedeliku jaoks
seda kiiret molekuli enam ei ole; et aga kiiruste jaotus peab
tasakaalustuma, kujunevad ülejäänud molekulide kiirused
uuesti tasakaaluliseks, kuid madalamal temperatuuril (koos
kiire molekuliga kaotsi läinud energia võrra). Kui auru osarõhk
ümbritsevas ruumis on alla küllastatuse piiri, jahtub vedelik
aurumise tõttu. Kui aur on küllastatud, tuleb sealt vedelikku
uus kiire molekul ja temperatuur ei muutu.
|
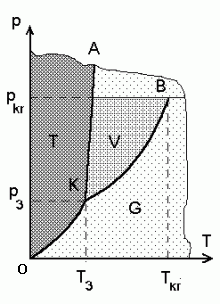
Olekudiagramm.
- Tahkumistemperatuur (kõver KA) ei sõltu rõhust.
- Keemistemperatuur (kõver KB) on seda madalam, mida madalam on rõhk. Kolmikpunktist K allpool vedel faas puudub.
- Kriitilisest temperatuurist (punkt B) kõrgematel temperatuuridel kaob erinevus vedela ja gaasilise faasi vahel.
|
Soojushulka, mida on tarvis ühe kilogrammi vedeliku
aurustamiseks, nimetatakse aurumissoojuseks.
See on seda
suurem, mida madalam on vedeliku temperatuur.
Aurumissoojust
keemistemperatuuril nimetatakse keemissoojuseks.
See
võrdub vedelikuhulga kõigi molekulide vaheliste jõudude
potentsiaalse koguenergiaga.
Kui rõhk tõuseb, suureneb ka keemistemperatuur ning väheneb
keemissoojus. Kriitilisel temperatuuril saab keemissoojus
nulliks ning kaob erinevus vedeliku ja gaasi vahel.
Et keemistemperatuur sõltub rõhust
kaunis tugevasti, tekib rõhu langedes olukord, kus
keemistemperatuur saab võrdseks sulamistemperatuuriga.
Seda
olekuparameetrit  kombinatsiooni, mille juures on
üheaegselt lubatud nii tahke, vedel kui gaasiline olek,
nimetatakse kolmikpunktiks.
Kolmikpunkt on antud aine
jaoks välistingimustest sõltumatu. Vee kolmikpunkti järgi on
defineeritud Kelvini kraad: üks Kelvin - 1/273.16 vee
kolmikpunkti temperatuurist. kombinatsiooni, mille juures on
üheaegselt lubatud nii tahke, vedel kui gaasiline olek,
nimetatakse kolmikpunktiks.
Kolmikpunkt on antud aine
jaoks välistingimustest sõltumatu. Vee kolmikpunkti järgi on
defineeritud Kelvini kraad: üks Kelvin - 1/273.16 vee
kolmikpunkti temperatuurist.
Faaside piirjooned määravad olekud, kus molekulide üleminekud
ühest olekust teise (näit. vedelast gaasilisse) on
võrdtõenäosed. Kõverast vasakul on tõenäolisem üleminek
gaasilisest olekust vedelasse suurem, kui vedelast gaasilisse;
temast paremal on olukord vastupidine. Muidugi võib vedel faas
eksisteerida mõnda aega ka kõrgemal temperatuuril, kuid see pole
tasakaal - vedelik aurustub ja tema hulk väheneb, kuni kas
temperatuur on langenud madalamale tasakaalutemperatuurist või
kogu vedelik aurustunud.
Kõvera kuju ja asukoht diagrammil sõltub molekuli ehitusest.
Polümorfsetel ainetel, millel on mitu kristalset
modifikatsiooni, on ka olekudiagramm keerulisem. On ka aineid
(näit. heelium), millel on mitu vedelat modifikatsiooni.
Tahkete ainete ja vedelike omaduste uurimine ja modelleerimine
on keeruline, huvitav ja tehnoloogia seisukohalt perspektiivikas
füüsikaharu. Pole ime, et sellega tegeleb tänapäeval suurem osa
kutselistest füüsikutest. Siia kanti kuulub ka näiteks
materjaliõpetus.
|
Osal ainetest on rohkem kui kolm erinevat faasi.
|